SALUD
23 de diciembre de 2020
LA ANMAT AUTORIZÓ EL SUERO EQUINO PARA EL TRATAMIENTO DE CORONAVIRUS
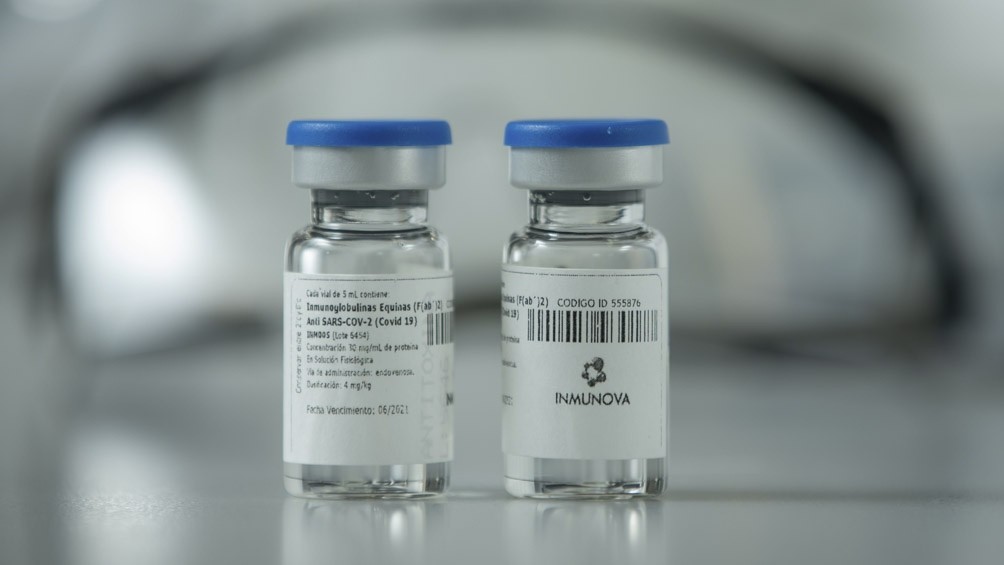
Se trata del suero equino hiperinmune para el tratamiento de pacientes con coronavirus moderado o severo.
Según la empresa que desarrolla el tratamiento, la aprobación se fundamentó "en los resultados positivos del estudio clínico de Fase 2/3 de INM005, los cuales mostraron que la aplicación de esta terapia, que demostró ser segura, redujo la mortalidad casi a la mitad" en los pacientes con Covid-19 severa.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) aprobó el uso del suero equino hiperinmune para el tratamiento del coronavirus, que en los estudios clínicos demostró ser seguro y reducir la mortalidad casi a la mitad en los pacientes con Covid-19 severa, según dio a conocer la empresa Inmunova que desarrolló el medicamento.
El suero, denominado CoviFab, fue aprobado por la entidad regulatoria mediante el Registro Bajo Condiciones Especiales, luego de que demostró ser seguro y efectivo para el tratamiento de pacientes adultos con enfermedad moderada a severa en el estudio clínico de Fase 2/3.
[Se trata del suero equino hiperinmune para el tratamiento de pacientes con coronavirus moderado o severo.]
Se trata del suero equino hiperinmune para el tratamiento de pacientes con coronavirus moderado o severo.
"El 9 de marzo tuvimos la primera reunión con el grupo de Covid en el Ministerio de Ciencia y Tecnología y ahí propusimos hacer un suero similar al que veníamos trabajando con el síndrome urémico hemolítico. Nos satisface poder contribuir con una opción terapéutica para mitigar los efectos de la Covid-19", dijo Linus Spatz, director de Inmunova, en la presentación de los resultados con medios de prensa.
El estudio
El estudio clínico evaluó la seguridad y eficacia del medicamento en 242 pacientes adultos (18 a 79 años) hospitalizados con enfermedad moderada a severa (confirmada por PCR), dentro de diez días del inicio de síntomas, donde a la mitad se le proveyó el suero hiperinmune INM005 y a la otra mitad un placebo.
Se realizó en 19 hospitales y clínicas de AMBA, Neuquén y Tucumán, y el promedio de edad fue de 54 años, con una participación de 65% varones y 35% mujeres.
"El primer paciente se enroló el 1 de agosto y el estudio terminó el 26 de octubre. Recibieron dos infusiones de plasma, una cuando se los recibía y otra en 48 horas. La infusión tarda 50 minutos. A los pacientes se los siguió por 4 semanas con visitas claves los días 7, 14, 21 y 28", explicó Gustavo Lopardo, infectólogo y coordinador general del ensayo clínico.
"Tenemos mucha tranquilidad con la seguridad, es decir, con los efectos adversos. Era una gran preocupación, pero nos sorprendió el resultado, no podíamos darnos cuenta de si el paciente había recibido suero o placebo", destacó.
[El estudio se realizó en 19 hospitales y clínicas de Área Metropolitana de Buenos Aires (AMBA), Neuquén y Tucumán.]
El estudio se realizó en 19 hospitales y clínicas de Área Metropolitana de Buenos Aires (AMBA), Neuquén y Tucumán.
El estudio mostró que el medicamento redujo la mortalidad casi a la mitad (45%) en los pacientes con Covid-19 severa, y los pacientes tratados registraron una reducción de la internación en terapia intensiva de 24% y del requerimiento de asistencia respiratoria mecánica de 36%, frente al placebo.
Los resultados
"Perseguíamos como objetivo que los pacientes bajen dos puntos en la escala ordinal de evaluación clínica de ocho puntos de la OMS a los 7, 14 y 21 días. Eran 60% moderados y 40% severos. En los severos fue donde más impacto tuvo el suero. La mortalidad en el grupo de placebo fue de 11,4%, mientras que los activos fue de 6,7%", precisó Lopardo.
Spatz aseguró que "el estudio clínico nos permitió determinar mediante el método científico que nuestro tratamiento anti-SARS-CoV-2 es seguro y eficaz con un beneficio clínico considerable, en especial en la población de pacientes severos, disminuyendo la progresión e impacto de la enfermedad".
Los datos y los resultados del estudio clínico de Fase 2/3 del suero hiperinmune, que es totalmente desarrollado en Argentina, serán enviados para publicación en una revista científica internacional, anunciaron los desarrolladores.
Fernando Goldbaum, director científico de Inmunova, que también dirige el Centro de Rediseño e Ingeniería de Proteínas de la UNSAM y el Laboratorio de Inmunología y Microbiología Molecular de la Fundación Instituto Leloir, destacó que "tuvimos resultados muy buenos, tiene una enorme capacidad neutralizante".
"Lo comparamos con el plasma de convalecientes y es 100 veces más potente. Estos anticuerpos tienen un formato diferente al que tienen el plasma de convaleciente y los anticuerpos monoclonales que se están utilizando en el hemisferio norte. Este es un anticuerpo bivalente, tiene la capacidad de unir dos antígenos y formar complejos inmunes", explicó.
Goldbaum aseveró que el CoviFab "es escalable en tiempos adecuados", por lo que se podría hacer un uso masivo en el país de este tratamiento en las próximas semanas.
"Empezamos trabajando con instituciones académicas que nos permitieron producir la proteína rápidamente. Tanto Inmunova como Instituto Biológico Argentino (BIOL) desarrollamos ese primer lote que nos permitió el ensayo clínico. A partir de ahí empezamos el proceso de escalado, pasamos de cientos de tratamientos a decenas de miles en la actualidad gracias a la interacción con la empresa mAbxience", indicó.
"Nuestros norte fue cubrir la necesidad para Argentina, pero por cantidad de producción podríamos enviar a otros países. El 10% de los pacientes positivos son moderados o severos, con 15 mil dosis por mes aun en una peor situación epidemiológica podríamos cubrir la demanda", aseguro Goldbaum.
El producto será de uso intrahospitalario y estará disponible para su aplicación en pacientes con enfermedad moderada a severa Covid-19 con la firma de consentimiento informado.
"Ya recibimos el interés de varios ministerios de Salud y obras sociales. La comercialización va a estar a cargo del laboratorio Elea y en precio vamos a estar muy por debajo de los anticuerpos monoclonales. El costo para el sistema de salud es enorme por la gente en terapia intensiva y con asistencia respiratoria, esto puede ayudar a mejorar eso en el sistema de salud", afirmó Spatz.
El proyecto de suero equino hiperinmune recibió financiamiento del Ministerio de Desarrollo Productivo a través de un crédito del Fondep en el marco del Programa de Asistencia al Sistema Productivo Nacional que apoyó la generación de insumos, equipamientos y soluciones para mitigar los efectos de la pandemia por parte de PyMEs, industrias, emprendedores, universidades e instituciones científico-tecnológicas.
A través de este programa, que puso en marcha la Secretaría de la Pequeña y Mediana Empresa y de los Emprendedores, se financiaron 214 proyectos por más de 2.300 millones de pesos, informaron desde el Ministerio encabezado por Matías Kulfas.
FUENTE - AGENCIA NA